Преимущества применения портативного кардиомонитора в амбулаторном наблюдении за пациентами с пароксизмальной формой фибрилляции предсердий
Цель. Изучение преимуществ использования портативного кардиомодуля (КМ) для самостоятельной регистрации электрокардиограммы (ЭКГ) при наблюдении за больными с пароксизмальной формой фибрилляции предсердий (ФП).
Материал и методы. Обследовано 88 пациентов (26 мужчин, 62 женщины, средний возраст 63 [57;68] лет), страдающих ФП сосредней частотой пароксизмов 1,0 [0,3;3,75] в мес. В группу дистанционного контроля (ДК) с использованием КМ ECG Dongle было включено 43 (49%) пациента, в группу традиционного наблюдения (ТН) — 45 (51%).
Пациенты проходили плановые осмотры через 2, 6 и 12 мес. от начала терапии, внеочередные консультации проводились при рецидиве ФП. Пациенты из группы ДК при помощи КМ дополнительно самостоятельно регистрировали ЭКГ 1 раз/нед. и дополнительно при возникновении симптомов, подозрительных на ФП. ЭКГ направлялись для анализа врачу-исследователю.
Результаты. С помощью КМ было собрано и проанализировано 2477 ЭКГ: на 2159 (87,2%) — синусовый ритм, на 318 (12,8%) — ФП и атипичное трепетание предсердий. 44 эпизода ФП у 3 пациентов протекали бессимптомно. 211 (8,5%) ЭКГ с синусовым ритмом зарегистрированы 13 пациентами при появлении симптомов, подозрительных на ФП. В группе ДК в связи с рецидивом ФП были госпитализированы 7 (16%) пациентов, в группе ТН — 20 (44%) пациентов (p=0,004). Суммарное число экстренных госпитализаций в группе ДК составило 8, в группе ТН — 29.
Число пациентов, вызывавших скорую медицинскую помощь (СМП), было достоверно меньше в группе ДК: в группе ТК было произведено 37 вызовов СМП 22 больными, в группе ДК — 12 пациентами произведено 15 вызовов (p=0,044). Доля вызовов с последующей госпитализацией (40 vs 70%, p=0,043) было достоверно ниже в группе ДК.
Заключение. Дистанционный контроль ЭКГ с использованием КМ
ECG Dongle является полезным способом наблюдения за пациентами с пароксизмальной формой ФП, который позволяет регистрировать бессимптомные пароксизмы ФП, дифференцировать причины сердцебиения, достоверно снижает частоту вызовов СМП и экстренных госпитализаций.
Ключевые слова: фибрилляция предсердий, дистанционное мониторирование, мобильное здравоохранение, антиаритмическая терапия, радиочастотная аблация, криобаллонная изоляция легочных вен.
Ключевые моменты
Что известно о предмете исследования?
• Применение портативных устройств регистрации электрокардиограммы эффективно при проведении скрининговых исследований для выявления фибрилляции предсердий (ФП) и для контроля эффективности терапии у пациентов с диагностированной ФП.
Что добавляют результаты исследования?
Использование портативного кардиомодуля ECG Dongle для дистанционного наблюдения за пациентами с ФП позволяет:
• достоверно снижать частоту вызовов скорой медицинской помощи и экстренных госпитализаций,
• регистрировать бессимптомные эпизоды ФП,
• при возникновении сердцебиений проводить дифференциальную диагностику с другими нарушениями ритма сердца.
Введение
В настоящее время лечение пациентов с пароксизмальной формой фибрилляции предсердий (ФП) является актуальной проблемой в связи с распространенностью аритмии в популяции и высокими темпами роста заболеваемости [1]. Кроме того, ФП — социально-значимое и экономически затратное нарушение ритма, которое обходится здравоохранению Российской Федерации (РФ) в ~52 млрд руб. в год, 9,2 млрд руб. из этой суммы относится к расходам на госпитализации [2]. Значительный вклад в структуру расходов вносит и оказание экстренной помощи как в стационарном, так и амбулаторном звене здравоохранения. Частота вызовов скорой медицинской помощи (СМП) в связи с ФП, составляет до 15% от числа всех вызовов по поводу сердечно-сосудистых заболеваний [3]. Представляется, что существенный вклад в диагностику и наблюдение за пациентами с ФП, позволяющий снизить нагрузку на амбулаторное звено и службу СМП, оптимизировать как лечебно-диагностическую, так и финансовую составляющую, могли бы внести технологии “мобильного здравоохранения”, активно развивающиеся в последние годы.
Речь идет, прежде всего, о возможности применения портативных приборов для самостоятельной регистрации пациентами электрокардиограммы(ЭКГ) в амбулаторных условиях с целью оценки эффективности антиаритмической терапии (ААТ) или катетерной изоляции (КИ) легочных вен (ЛВ), своевременного выявления кардиальных побочных эффектов антиаритмических препаратов (ААП).
[4]. Особое значение технологии мобильного здравоохранения получили в период пандемии новой коронавирусной инфекции (COVID-19, Corona VIrus Disease 2019), когда возникла необходимость ограничения социальных контактов, в т.ч. за счет снижения частоты посещения медицинских учреждений. Пандемия ускорила принятие ряда важных организационных решений, необходимых для функционирования системы дистанционного наблюдения за пациентами. Согласно изменениям, вступившим в силу с 01.01.2022г, в статье 36.2 закона “Об основах охраны здоровья граждан в Российской Федерации” после первого очного визита к врачу в дальнейшем возможно дистанционное наблюдение за состоянием здоровья пациента с применением медицинских изделий, предназначенных для мониторирования состояния здоровья человека 1,2. В 2021г был опубликован Консенсус экспертов Международного общества холтеровского мониторирования (ХМ) и неинвазивной электрокардиологии по контролю аритмий с помощьютехнологий мобильного здравоохранения, где обобщен опыт, накопленный в это сфере. Вместе с тем, большинство исследований с применением портативных устройств были направлены на скрининг ФП в различных популяциях [5, 6]. Работы же, посвященные дистанционному наблюдению за пациентами с уже установленным диагнозом ФП немногочисленны [7-9], а в РФ ранее не проводились.
Цель настоящего исследования — изучение преимуществ использования портативного кардиомодуля (КМ) ECG DONGLE для самостоятельной регистрации ЭКГ по сравнению с традиционными методами наблюдения за больными с пароксизмальной формой ФП.
Материал и методы
Настоящее исследование является частью проспективного исследования по сравнению эффективности и безопасности ААП I C класса и КИ ЛВ при пароксизмальной форме ФП у лиц без структурной патологии сердца, одобренного локальным этическим комитетом.
Критерии включения: пароксизмы ФП, сопровождающиеся клинической симптоматикой и возникающие не <1 раза/3 мес. на протяжении как минимум последних 6 мес., возраст ≥18 лет, письменное информированное согласие пациента на участие в исследовании. Критерии невключения: наличие структурной патологии сердца — ишемической болезни сердца, пороков сердца, кардиомиопатии любого генеза, инфильтративные поражения сердца, гипертрофия левого желудочка (ЛЖ) любого генеза, систолическая дисфункция ЛЖ, каналопатии, наличие дополнительных предсердно-желудочковых соединений, пароксизмы устойчивой желудочковой тахикардии, атриовентрикулярные блокады II и III ст. Без имплантированного электрокардиостимулятора, ранее выполненные любые хирургические и малоинвазивные вмешательства на сердце, анемия, аутоиммунные заболевания, тиреотоксикоз, беременность, кормление грудью, отказ от участия в исследовании.
С сентября 2019 по февраль 2021гг в исследование включены 88 пациентов (26 мужчин, 62 женщины, средний возраст 63 [57;68] лет), страдающих симптомными пароксизмами ФП со средней частотой 1,0 [0,3;3,75] в мес. Средняя давность аритмического анамнеза составила 3 [2;6] лет. Все пациенты прошли обследование на базе университетской клинической больницы № 1
Первого МГМУ им. И.М. Сеченова, в рамках которого проводилось исключение структурной патологии сердца и некардиальных причин ФП. Всем больным помимо сбора жалоб и анамнеза проводились общий и биохимический анализы крови, определение уровня тиреотропного гормона в крови, выполнено эхокардиографическое исследование и ХМ ЭКГ, а у лиц >60 лет или при наличии жалоб на боли в области сердца дополнительно исключали ишемическую болезнь сердца с помощью нагрузочных тестов, мультиспиральной компьютерной томографии коронарных артерий или коронарографии.
При включении в исследование допускалось наличие гипертонической болезни, которая диагностирована у 62 (70,5%) пациентов, без гипертрофии ЛЖ. Пациентам проводилась профилактика тромбоэмболических осложнений ФП в соответствии с действующими рекомендациями3
[10]. После обследования 58 (66%) пациентам был назначен один из ААП I C класса, выбор которого осуществлялся у 50 (57%) пациентов случайным образом (при отсутствии предшествующего опыта приема препаратов данной группы), у 8 (9%) больных, ранее принимавших то или иное средство I C класса, с учетом предшествующего опыта ААТ. 30 (34%) пациентам выполнена
КИ ЛВ: 21 (24%) больному — радиочастотная аблация
(РЧА) ЛВ, 9 (10%) больным — криобаллонная изоляция
(КБИ). Показанием к выполнению КИ явился выбор больным хирургического лечения при неэффективности как минимум одного ААП [3]. С целью профилактикиранних рецидивов ФП после КИ ЛВ в течение первых 2мес. 91% пациентов получали ААТ (таблица 1). После выписки из стационара наблюдение за больными осуществлялось в амбулаторном режиме. Все пациенты были разделены на 2 группы по методу амбулаторного наблюдения:
— группа традиционного наблюдения (ТН), которая включала 45 пациентов. Пациенты этой группы через 3, 6 и 12 мес. после включения в исследование осуществляли плановые контрольные визиты в клинику с регистрацией ЭКГ и проведением ХМ ЭКГ. Кроме того,в случае возникновения приступа учащенного сердцебиения больным была рекомендована регистрация ЭКГ в момент пароксизма с последующей внеочередной консультацией в клинике для коррекции терапии. Регистрация ЭКГ в зависимости от переносимости аритмии осу
ществлялась либо выездной бригадой СМП, либо в одном из медицинских учреждений по месту жительства пациента. Способ купирования настоящего пароксизма
ФП определялся врачами первого контакта (чаще всего врачами выездной бригады СМП);
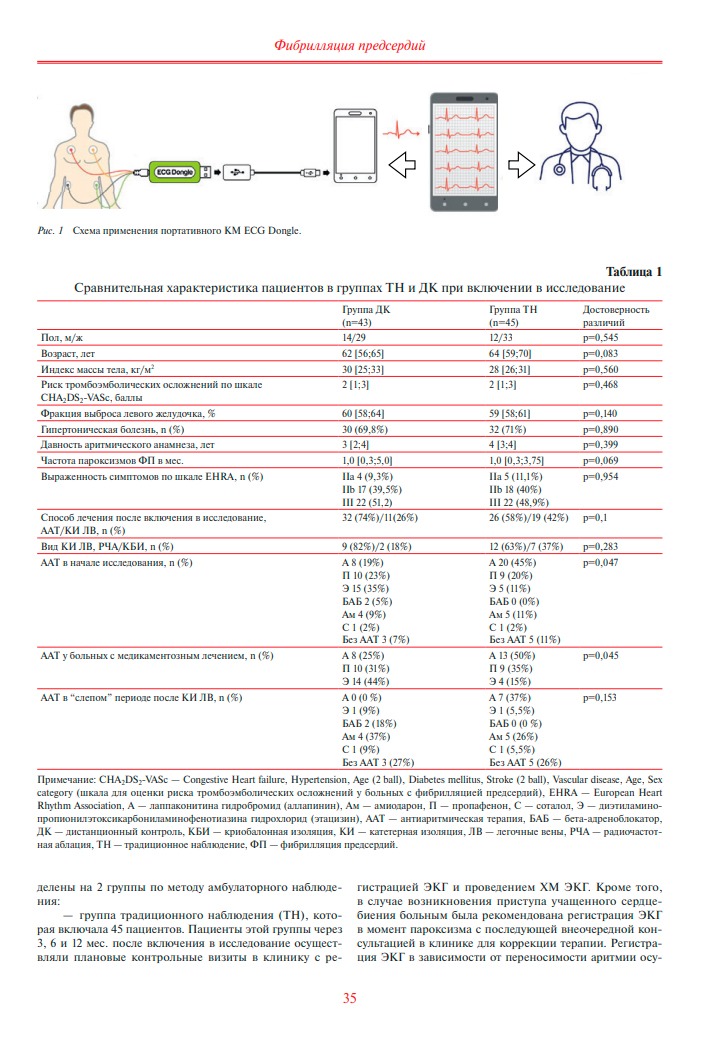
— группа дистанционного контроля (ДК) включала 43 пациента, в нее вошли пациенты, которые обладали технической базой для использования КМ. Больные этойгруппы помимо плановых визитов в клинику через 3, 6 и 12 мес. (аналогично группе ТН) дополнительно самостоятельно регистрировали ЭКГ в амбулаторных условиях с помощью портативного КМ ECG Dongle (ГК “Нордавинд”, РФ, регистрационное удостоверение № РЗН 2019/8179 от 13.08.2019г). Устройство включает в себя блок-кардиофлешку ECG Dongle, OTG либо type-Cпереходник для соединения со смартфоном пациента, кабель отведений и многоразовые электроды. Программное обеспечение, необходимое для работы КМ, устанавливается в виде мобильного приложения. При подключении КМ к смартфону пациента (рисунок 1) устройство
позволяет регистрировать ЭКГ длительностью от 30 сек до 10 мин в шести стандартных отведениях (рисунки 2 и 3) с сохранением в формате PDF на смартфоне пациента или направлением для анализа на сервер Нордавинд либо лечащему доктору на адрес электронной почты или мессенджера. Все пациенты из группы ДК при включении в исследование регистрировали тестовую ЭКГ и отправляли ее исследователю с целью предотвращения некорректного использования прибора. При последующем наблюдении с целью контроля эффективности ААТ или КИ ЛВ больные самостоятельно регистрировали ЭКГ с периодичностью 1 раз/нед., а также дополнительно при возникновении симптомов, подозрительных на рецидив ФП, таких как учащенное неритмичное сердцебиение, перебои в работе сердца, одышка, боль в грудной клетке.
Все ЭКГ отправлялись лечащим врачам (2 врача-кардиолога со стажем работы 5 лет и 24 года). На полученных ЭКГ анализировался ритм, частота сердечных сокращений, интервалы PQ, QRS, QT. При выявлении нарушений ритма врач-исследователь связывался по телефону с пациентом, информировал о наличии или отсутствии
показаний к купированию аритмии и давал рекомендации по дальнейшей тактике лечения. В случае смены
ААП пациенты регистрировали и отсылали ЭКГ с периодичностью, рекомендованной для конкретного препарата4 до подбора оптимальной дозы. После подбора дозы вновь возвращались к режиму регистрации ЭКГ 1 раз/нед.
Группы ТН и ДК были сопоставимы по основным демографическим и клиническим характеристикам (таблица 1), за исключением большей частоты назначения лаппаконитина гидробромида и меньшей частоты приема диэтиламинопропионилэтоксикарбониламинофенотиазина гидрохлорида (этацизина) в группе ТН на момент начала наблюдения. В таблице 1 представлена ААТ в группах ТН и ДК как у всех пациентов, так и отдельно у больных с медикаментозным лечением и после КИ ЛВ. Период наблюдения составил 12 мес. Рецидивом ФП считался пароксизм ФП продолжительностью ≥30 сек, зарегистрированный с помощью ЭКГ [11].
В группах ДК и ТН оценивали частоту вызовов СМП по поводу ФП, частоту экстренных госпитализаций в связи с рецидивом ФП, эффективность первично выбранного метода лечения, частоту смены терапии и ее эффективность. При анализе числа госпитализаций исключались случаи плановых госпитализаций для проведения КИ ЛВ. В группе ДК дополнительно оценивали долю ЭКГ с зарегистрированной симптомной и бессимптомной ФП, а также долю ЭКГ с синусовым ритмом при наличии субъективных симптомов, расцененных пациентами как приступ ФП.
Статистическую обработку данных осуществляли с помощью программного обеспечения SPSS версии 4 Приказ Минздрава РФ от 12 мая 2021 года N 435н “Об утверждении стандарта медицинской помощи взрослым при фибрилляции и трепетании предсердий (диагностика, лечение и диспансерное наблюдение)”. http://publication.pravo.gov.ru/
Document/View/0001202106020037.
23.0. Данные представлены в виде медианы (Me) и интерквартильного размаха [Q25;Q75] или процента от общего числа пациентов. Достоверность различий между группами оценивали с помощью непараметрических методов: критерия Манна-Уитни, критерия χ2.
Вероятность р<0,05 считали достаточной для вывода о достоверности различий между вариационными рядами.
Результаты
За время наблюдения с помощью КМ было собрано и проанализировано 2477 ЭКГ. На 2159 (87,2%) зарегистрирован синусовый ритм, на 318 (12,8%) ЭКГ, полученных от 21 пациента, обнаружена ФП, а у двух больных (2 ЭКГ) из их числа —атипичное трепетание предсердий. 44 эпизода ФП, зарегистрированные у трех пациентов, протекали бессимптомно, что составило 1,8% от общего количества ЭКГ или 13,8% от числа ЭКГ с зарегистрированной ФП. Кроме того, 13 пациентами (30,2% от состава группы) в период появления субъективных ощущений, ошибочно расцененных больными как пароксизм ФП, зарегистрировано 211 ЭКГ (8,5% от всех зарегистрированных ЭКГ) с синусовым ритмом, в т.ч. с предсердной или желудочковой экстрасистолией. Из этих больных у 5 человек за время наблюдения регистрировались и пароксизмы ФП, тогда как у 6 (46%) из 13 пациентов рецидиваФП в течение 12 мес. не отмечено.
В течение года в группе ДК рецидивы ФП зарегистрированы у 21 (48,8%) больного. После смены лечения у 10 (23,2%) из этих пациентов достигнут антиаритмический эффект: 2 пациентам подобран эффективный ААП, 9 больным выполнена КИ ЛВ: у 5 первичная и у 2 повторная — РЧА, у 2 — криобалонная изоляция (КБИ) ЛВ. У 9 (21%) пациентов, несмотря на смену лечения, пароксизмы ФП продолжали рецидивировать, у одной (2,3%) больной установилась постоянная форма ФП (таблица 2).
В группе ТН за 12 мес. наблюдения у 24 (53,3%) пациентов были зарегистрированы рецидивы ФП.
После смены лечения у 10 (22,2%) больных удалось добиться стойкого синусового ритма: у 4 пациентов за счет выполнения КИ ЛВ (в 2 случаях первичная, и в 1 — повторная РЧА, в 1 случае — КБИ ЛВ), 6 пациентам подобрана эффективная ААТ. У одной (2,2%) больной установилась постоянная форма
ФП и у 13 (28,9%) пациентов сохранялись пароксизмы ФП, несмотря на проводимое лечение. По результатам лечения группы ДК и ТН не различались (p=0,750) (таблица 2).
За 12 мес. наблюдения в связи с рецидивом ФП в группе ДК были экстренно госпитализированы 7 (16%) пациентов, что было достоверно меньше, чем в группе ТН, где в госпитализации нуждались 20 (44%) пациентов (p=0,004). В группе ДК 6 пациентов в течение года были экстренно госпитализированы 1 раз, 1 пациент — 2 раза. Суммарное число экстренных госпитализаций в этой группе составило 8. В группе ТН 16 пациентов были госпитализированы 1 раз, 3 пациента — 2 раза, 1 пациент — 3 раза, 1 пациентка — 4 раза. Суммарное число экстренных госпитализаций в этой группе составило 29. Большинство госпитализаций осуществлялись выездными бригадами СМП, а в 3 случаях в группе ТН и в 2 случаях в группе ДК — в результате самообращения пациентов в стационар.
СМП в группе ДК 1 раз вызывали 9 пациентов, 3 пациентов — 2 раза. Всего суммарно 12 пациентами группы за год было произведено 15 вызовов.
В группе ТН вызывали СМП 1 раз 11 пациентов, 2 раза — 8 пациентов, 3 раза — 2 пациента, 4 раза — 1 пациентка. Суммарно 22 больными произведено 37 вызовов. Доля пациентов, вызывавшихСМП (28 vs 49%, p=0,044), и доля вызовов с последующей госпитализацией (40 vs 70%, p=0,043) была достоверно ниже в группе ДК.
Обсуждение
Внедрение в клиническую практику разных стран передачи результатов ЭКГ при помощи телефонной связи началось еще ко второй половинеXXв, когда специальными устройствами оснащались медицинские центры или выездные бригады СМП [10, 11]. Уже в то время исследователи пришли к выводу, что такая организация снижает затраты системы здравоохранения на выезд служб неотложной помощи и уменьшает частоту необоснованных госпитализаций [10, 11]. Дальнейшее развитие этого направления было связано с разработкой компактных приборов для самостоятельной регистрации ЭКГ пациентами. В настоящее время создано большое число различных портативных устройств с возможностями регистрации 1-2 отведений ЭКГ, сохранением данных и/или их передачи по сети Интернет [6, 7, 12]. Безусловно, позитивные результаты от применения устройств для самостоятельной регистрации ЭКГ могут быть получены только лишь при обеспечении их доступности (в т.ч. финансовой) в виде потребительского товара
[13]. С этой точки зрения наибольшей привлекательностью обладают устройства на базе смартфонов, к которым относится использованный нами КМ ECG DONGLE. Другое преимущество данного прибора — это возможность регистрации 6 отведений ЭКГ, что облегчает дальнейшую интерпретацию кардиограмм. Обратной стороной этого преимущества является необходимость самостоятельного наложения пациентом электродов на грудную клетку. В ходе исследования некоторые больные допускали ошибки в расположении отведений. И хотя это не мешало оценке ритма сердца, в таких случаях исследователи связывались с пациентом, и напоминали правильный порядок регистрации ЭКГ.
Кроме того, недостатком КМ ECG DONGLE является совместимость со смартфонами, функционирующими на базе операционной системы Android.
В настоящее время проведено >500 исследований по оценке точности скрининга нарушений ритма сердца с применением технологий мобильного здравоохранения, в которых основное внимание уделяется ранней диагностике ФП в различных группах населения [12-14]. Отмечается, что применение портативных устройств при краткосрочном мониторировании обладает чувствительностью 94-100% и специфичностью 90-97% в плане диагностики ФП при сравнении с данными, получаемыми с помощью стандартной ЭКГ [13]. Использованию же подобных приборов для длительного наблюдения за пациентами с уже установленным диагнозом ФП, в т.ч. с целью оценки эффективности и коррекции ААТ, посвящено гораздо меньшее число исследований. Методы дистанционного контроля ЭКГ были использованы для оценки эффективности терапии бепридилом [8], дронедароном [9], флекаинидом [15]. Больше работ посвящено применению дистанционного контроля ЭКГ в оценке эффективности КИ ЛВ [16-18]. В широко известном исследовании CABANA (The Catheter Ablation vs Antiarrhythmic Drug Therapy for Atrial Fibrillation) с целью выявления рецидивов ФП у значительной части пациентов использована система Medicomp с возможностями не только “событийного” регистратора, но и ХМ [7]. В работе Gupta D, et al. [18]аналогично нашему исследованию применялся ткомбинированный метод наблюдения, сочетавшийеженедельный транстелефонный контроль ЭКГ и ХМ через 3, 6 и 12 мес. Наиболее близким нашему исследованию по задачам и результатам является исследование Aljuaid M, et al [19]. Оно включало 90 больных, перенесших КИ ЛВ и разделенных на две равные группы: с ТН и с ежедневной регистрацией и передачей в исследовательский центр ЭКГ, зарегистрированной с помощью устройства на базе смартфона. Период наблюдения составил 100 дней, в течение которых число пациентов, которые обращались в службу СМП в связи с рецидивом ФП, как и в нашем исследовании, было достоверно ниже в группе ДК (13 vs 33%).
Безусловно, снижение частоты госпитализаций и вызовов СМП не может быть объяснено различиями в частоте рецидивирования ФП: в нашем исследовании по суммарной эффективности лечения группы ДК и ТН не различались (76,7 и 68,9% соответственно, p=0,409). Наоборот, использование КМ позволило дополнительно зарегистрировать 13,8% случаев бессимптомной ФП, а в исследовании Atarashi H, et al. [15] частота бессимптомной ФП, зарегистрированной у симптомных пациентов, была еще выше и составила 22,4%. В снижении частоты вызовов СМП и госпитализаций основное значение имеет, во-первых, уменьшение частоты необоснованных вызовов СМП в случае появления симптомов, субъективно схожих с пароксизмом ФП: в нашем исследовании число ЭКГ с синусовым ритмом, зарегистрированных в подобной ситуации, было лишь в 1,5 раза меньше, чем всех ЭКГ с ФП. В других работах [15, 20] число таких ЭКГ составило 40-46,4% от числа ЭКГ, переданных в момент сердцебиения. Во-вторых, в случае удовлетворительной переносимости аритмии и отсутствия показаний для ее купирования у пациентов из группы ДК не было необходимости вызывать СМП для верификации рецидива ФП с целью оценки эффективности проводимой терапии.
В-третьих, на основании знаний об особенностях течения ФП у конкретного больного, исследователями дистанционно давались рекомендации по необходимым мероприятиям при рецидиве аритмии.
В тех ситуациях, когда предполагалось спонтанное купирование пароксизма, эти мероприятия могли включать лишь прием бета-адреноблокаторов для уменьшения симптоматики тахисистолии, в редких случаях — использование тактики “таблетка в кармане” с применением пропафенона и дополнительным дистанционным контролем ЭКГ. Однако обращает на себя внимание, что в группе ДК пациенты не только реже обращались в службу СМП, но и доля вызовов с последующей госпитализацией была достоверно ниже, чем в группе ТН (40% по сравнению с 70%). Это позволяет предположить, что пациенты в группе ДК чаще чувствовали уверенность, находясь под наблюдением врача-исследователя, и отказывались от экстренной госпитали зации в пользу плановой консультации с дальнейшей коррекцией лечения. Ранее было показано, что контакты с врачом по телефону способствуют повышению комплаентности пациентов с сердечно-сосудистой патологией [21], а использование смартфона для регистрации ЭКГ в течение 6 мес. способствует повышению качества жизни пациентов, оцениваемому по шкалам и физического, и психического здоровья [22].
Несмотря на то, что достоинства системы дистанционного наблюдения за пациентами с сердечно-сосудистой патологией продемонстрированы в целом ряде научных исследований, перенос их результатов на повседневную медицинскую практику сопряжен с целым рядом трудностей, прежде всего организационного характера. Огромный массив ЭКГ при организации дистанционного наблюдения в большом масштабе требует выделения значительной части рабочего времени специалиста, в то время как в большинстве стран модели возмещения расходов в этой области не отработаны [13]. Кроме того, необходимо учитывать “информационно-цифровой барьер”, возникающий при применении смартфонов у пожилых и малообеспеченных пациентов [13].
Ограничением настоящей работы является относительно небольшое количество пациентов, включенных в исследование. Кроме того, не изучались оптимальные сроки наблюдения, режим и частота регистрации ЭКГ для достижения лучших результатов. Также в исследовании не сравнивались различные методики дистанционного кардиомониторирования. Безусловно, необходимо проведение более масштабных исследований по выявлению экономических преимуществ дистанционного кардиомониторирования, а также оценка его влияния на исходы заболевания.
Заключение
Дистанционный контроль ЭКГ с использованием КМ ECG Dongle является полезным способом наблюдения за пациентами с пароксизмальной формой ФП, который позволяет регистрировать бессимптомные пароксизмы ФП, дифференцировать причины сердцебиения, достоверно снижает частоту вызовов СМП и экстренных госпитализаций, что особенно актуально в период пандемии новой коронавирусной инфекции. Дальнейшее развитие метода и его широкое внедрение в клиническую практику требует проведения целого ряда мероприятий организационного характера.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Литература/References
1. Brand FN, Abbott RD, Kannel WB, et al. Characteristics and prognosis of atrial fibrillation: 30-year follow-up in the Framingham Study. JAMA. 1985;254:3449-53.
2. Kolbin AS, Mosikyan AA, Tatarsky BA. Socioeconomic burden of atrial fibrillation in Russia (2010-2017). J Arrhythmology. 2018;(92):42-8. (In Russ.) Колбин А. С., Мосикян А.А., Татарский Б. А. Социально-экономическое бремя фибрилляции предсердий в России: динамика за 7 лет (2010-2017гг).
Вестник аритмологии. 2018;(92):42-8.
3. Plavunov NF, Gaponova NI, Kadyshev VA, et al. Clinical and statistical evaluation of the calls of patients with atrial fibrillation. The Russian Archives of Internal Medicine. 2018;8(5):389-93. (In Russ.) Плавунов Н.Ф., Гапонова Н.И., Кадышев В.А. и др.
Клинико-статистический анализ пациентов с фибрилляцией предсердий. Архивъ внутренней медицины. 2018;8(5):389-93. doi:10.20514/2226-6704-2018-8-5-389-393.
4. Arakelyan MG, Bockeria LA, Vasilieva EYu, et al. Clinical guidelines for Atrial fibrillation and atrial flutter. Russian Journal of Cardiology. 2021;26(7):4594. (In Russ.) Аракелян М. Г., Бокерия Л. А., Васильева Е. Ю. и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020.
Российский кардиологический журнал. 2021;26(7):4594. doi:10.15829/1560-4071-2021-4594.
5. Petrosyan YM, Dumbadze RD, Bakshanskaya EO, et al. The effectiveness of atrial fibrillation screening with the My Dyagnostick 1001R device in a population and in a group at risk. Russian Family Doctor. 2019;23(4):41-8. (In Russ.)
Петросян Ю. М., Думбадзе Р. Д., Бакшанская Е. О. и др.
Эффективность скрининга фибрилляции предсердий с помощью портативного устройства MyDyagnostick 1001R в популяции и в группе риска. Российский семейный врач. 2019;23(4):41-8. doi:10.17816/RFD18929.
6. Anczykowski J, Willems S, Hoffmann BA, et al. Early detection of symptomatic paroxysmal cardiac arrhythmias by transtelephonic ECG monitoring: impact on diagnosis and treatment of atrial fibrillation. J Cardiovasc Electrophysiol. 2016;27:1032-7.
7. Packer DL, Mark DB, Robb RA, et al; CABANA Investigators. Catheter Ablation versus Antiarrhythmic Drug Therapy for Atrial Fibrillation (CABANA) Trial: Study Rationale and Design. Am Heart J. 2018;199:192-9. doi:10.1016/j.ahj.2018.02.015.
8. Yamashita T, Ogawa S, Sato T, et al; J-BAF Investigators. Doseresponse effects of bepridil in patients with persistent atrial fibrillation monitored with transtelephonic electrocardiograms: a multicenter, randomized, placebo-controlled, double-blind study (J-BAF Study). Circ J. 2009;73(6):1020-7. doi:10.1253/circj.cj-08-1061.
9. Klingenheben T, Albakri A, M Helms T. Transtelephonic ECG Monitoring to Guide Outpatient Antiarrhythmic Drug Therapy in Patients With Non-Permanent Atrial Fibrillation: Efficacy and Safety From a Single-Center Experience. J Atr Fibrillation. 2019;11(6):2161. doi:10.4022/jafib.2161.
10. Chireykin LV, Dovgalevskiy PYa. Remote diagnostic cardiology centers. S-Pb., 1995. 232p. (In Russ.) Чирейкин Л.В., Довгалевский П.Я. Дистанционные диагностические кардиологические центры. С-Пб.: [б. и.], 1995. 232 с. ISBN: 5-88377-001-0.
11. Bertazzoni G, Genuini I, Aguglia F. Telecar: an Italian telecardiology project. J Telemed Telecare. 1996;2(3):132-5. doi:10. 1258/1357633961929943.
12. Devyashina KS, Oganyan KG, Panchoyan SM, et al. The possibility of early diagnostics of atrial fibrillation in patients with high risk of it’s development. Russian Family Doctor. 2018;22(2):14-8. (In Russ.) Девяшина К. С., Оганян К. Г.,
Панчоян С. М. и др. Возможность раннего выявления фибрилляции предсердий у пациентов с высоким риском ее развития. Российский семейный врач. 2018;22(2):14-8. doi:10.17816/RFD2018214-18.
13. Varma N, Cygankiewicz I, Turakhia M, et al. 2021 ISHNE/ HRS/EHRA/APHRS Collaborative Statement on mHealth in Arrhythmia Management: Digital Medical Tools for Heart Rhythm Professionals: From the International Society for Holter and Noninvasive Electrocardiology/Heart Rhythm Society/European Heart Rhythm Association/Asia Pacific Heart Rhythm Society.
Ann Noninvasive Electrocardiol. 2021;26(2):e12795. doi:10.1111/ anec.12795.
14. Kaasenbrood F, Hollander M, de Bruijn SH, et al. Opportunistic screening versus usual care for diagnosing atrial fibrillation in general practice: a cluster randomised controlled trial. Br J Gen Pract. 2020;70(695):e427-33. doi:10.3399/bjgp20X708161.
15. Atarashi H, Ogawa S, Inoue H; Flecainide Atrial Fibrillation Investigators. Relationship between subjective symptoms and trans-telephonic ECG findings in patients with symptomatic paroxysmal atrial fibrillation and flutter. J Cardiol. 2008;52(2):102-
10. doi:10.1016/j.jjcc.2008.06.006.
16. Tarakji KG, Wazni OM, Callahan T, et al. Using a novel wireless system for monitoring patients after the atrial fibrillation ablation procedure: the iTransmit study. Heart Rhythm. 2015;12(3):554-9. doi:10.1016/j.hrthm.2014.11.015.
17. Senga M, Fujii E, Sugiura S, et al. The Utility of Transtelephonic Electrocardiograms for Detecting Arrhythmia Recurrences after Radiofrequency Catheter Ablation for Atrial Fibrillation. J Arrhythmia. 2009;25(3):130-4.
18. Gupta D, Vijgen J, Potter T, et al. Quality of life and healthcare utilisation improvements after atrial fibrillation ablation. Heart. 2021;107(16):1296-302. doi:10.1136/heartjnl-2020-318676.
19. Aljuaid M, Marashly Q, AlDanaf J, et al. Smartphone ECG Monitoring System Helps Lower Emergency Room and Clinic Visits in Post-Atrial Fibrillation Ablation Patients.Clin Med Insights Cardiol. 2020;14:1179546820901508. doi:10.1177/1179546820901508.
20. Israel CW, Gronefeld G, Ehrlich JR, et al. Long-term risk of recurrent atrial fibrillation as documented by an implantable monitoring device: implications for optimal patient care. J Am Coll Cardiol. 2004;43:47-52. doi:10.1016/j.jacc.2003.08.027.
21. Vollmer WM, Owen-Smith AA, Tom JO, et al. Improving adherence to cardiovascular disease medications with information technology. Am J Manag Care. 2014;20(SP17):SP502-10.
22. Hickey KT Biviano AB, Garan H, et al. Evaluating the utility of mHealth ECG heart monitoring for the detection andӯmanagement of atrial fibrillation in clinical practice. J Atr
Fibrillation. 2017;9(5):1546. doi:10.4022/jafib.1546.

